염화 티오닐
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염화 티오닐(SOCl2)은 삼산화 황과 이염화 황의 반응을 통해 산업적으로 합성되며, 다양한 유기 화합물의 합성에 사용되는 무색의 액체이다. 분자 구조는 삼각뿔 형태를 가지며, 물과 격렬하게 반응하여 염산과 이산화 황을 생성한다. 알코올, 카복실산, 질소 화합물, 황 화합물 등 다양한 물질과 반응하며, 유기염소 화합물 생산의 중간체로 활용된다. 또한 리튬 전지의 구성 요소로 사용되지만, 높은 반응성과 독성으로 인해 취급에 주의가 필요하다. 1849년 최초로 합성되었으며, 1857년 휴고 쉬프에 의해 순수한 형태로 분리되었다.
더 읽어볼만한 페이지
- 최루제 - 아크롤레인
아크롤레인은 자극적인 냄새를 가진 무색 또는 황색 액체로, 아크릴산 및 아크릴 플라스틱 산업 생산의 중요한 중간체로 사용되며, 다양한 방법으로 생산되고 반응성이 높아 여러 화학 반응에 참여하며 독성과 가연성이 있어 취급 시 주의가 필요하고 다양한 용도로 활용된다. - 최루제 - 아세트산 무수물
아세트산 무수물은 강한 신맛과 자극적인 냄새를 가진 무색 액체 화합물로, 아세틸화 반응 시약으로 사용되며 셀룰로스 아세테이트, 아스피린 생산과 헤로인 제조에 사용될 수 있어 규제 물질로 지정되기도 한다. - 무기 용매 - 물
물은 산소 원자 하나와 수소 원자 두 개로 이루어진 무기 화합물로, 지구 표면의 약 70%를 차지하며 고체, 액체, 기체 상태로 존재하고 생명체의 필수 구성 요소이자 문명과 밀접한 관련이 있지만 물 부족과 수질 오염 문제가 심각해지고 있다. - 무기 용매 - 이산화 탄소
이산화탄소(CO₂)는 탄소 원자 하나와 산소 원자 두 개로 이루어진 무색·무취의 기체로, 드라이아이스로 승화하며, 탄산 형성, 연소, 호흡, 광합성 등 다양한 과정에서 발생하고, 산업적으로 널리 사용되지만 지구 온난화의 주요 원인이자 고농도에서 인체에 유독한 물질이다.
2. 제조
염화 티오닐은 주로 산업적 합성과 실험실 제법으로 제조된다.
산업적 합성 방법에는 삼산화 황과 이염화 황의 반응, 오염화 인 사용, 염소와 이염화 황 반응, 포스겐 사용 등이 있다.[9][46]
실험실 제법으로는 삼산화 황과 이염화 황을 반응시키거나, 오염화 인, 염소, 포스겐, 사염화 황, 이염화 이황 등을 이산화황과 반응시켜 제조하는 방법이 있다.[46]
2. 1. 산업적 합성
염화 티오닐의 주요 산업적 합성은 삼산화 황과 이염화 황의 반응을 포함한다.[9]다른 방법으로는 다음 물질로부터의 합성이 있다.
- 오염화 인:[46]
::
- 염소와 이염화 황:[46]
::
::
- 포스겐:
::
이염화 황 SCl2을 삼산화 황 SO3 또는 발연 황산 또는 클로로설폰산 ClSO3H로 산화하여 제조한다. 특히 후자의 두 가지는 염화 안티몬 등을 촉매로 사용하면 반응하기 쉽다.[46]
:
:
2. 2. 실험실 제법
염화 티오닐은 실험실에서 다음과 같은 방법으로 합성할 수 있다.[9][10][46]- 삼산화 황과 이염화 황 반응: 발연황산을 가열하여 삼산화 황을 서서히 증류하여 냉각된 이염화 황 플라스크로 옮겨 합성한다.[10]
::
- 오염화 인과 이산화황 반응:
::
:: 부생성물로 생성되는 염화 포스포릴은 증류를 통해 분리한다.
- 염소와 이염화 황 반응:
::
::
- 포스겐과 이산화황 반응:
::
- 사염화 황과 이산화황 반응: 활성탄 촉매 하에 반응시키고, 생성물을 증류하여 얻는다.
::
- 이염화 황, 염소 혼합물과 이산화황 반응:
::
- 이염화 이황, 염소 혼합물과 이산화황 반응:
::
3. 성질 및 구조
염화 티오닐은 벤젠, 클로로포름, 사염화 탄소 등 유기 용매에 잘 녹는다. 반면 물과는 격렬하게 반응하여 이산화 황(SO2)과 염화 수소(HCl) 기체를 생성한다. 이러한 성질 때문에 염화 티오닐은 물을 제거하는 탈수제나, 카르복실산 및 알코올을 염소화하는 반응에 유용하게 사용된다.[11]
:
:
:
특히 반응 후 생성되는 물질들이 기체이거나 끓는점이 낮아 쉽게 제거할 수 있다는 장점 때문에, 실험실에서 히드록시기(-OH)를 염소화하는 반응에 많이 사용된다.
염화 티오닐을 이용한 알코올의 염소화 반응은 SN1이나 SN2 메커니즘이 아닌, SNi 메커니즘으로 진행된다. 이 반응은 왈덴 반전 없이 입체화학이 보존되는 특징을 가지며, 사원환 전이 상태를 거치는 것으로 알려져 있다.
140 ℃ 이상으로 가열하면 분해가 시작되며, 500 ℃에서는 완전히 분해되어 이산화 황, 이염화 이황, 염소 기체를 생성한다.[46]
:
3. 1. 분자 구조
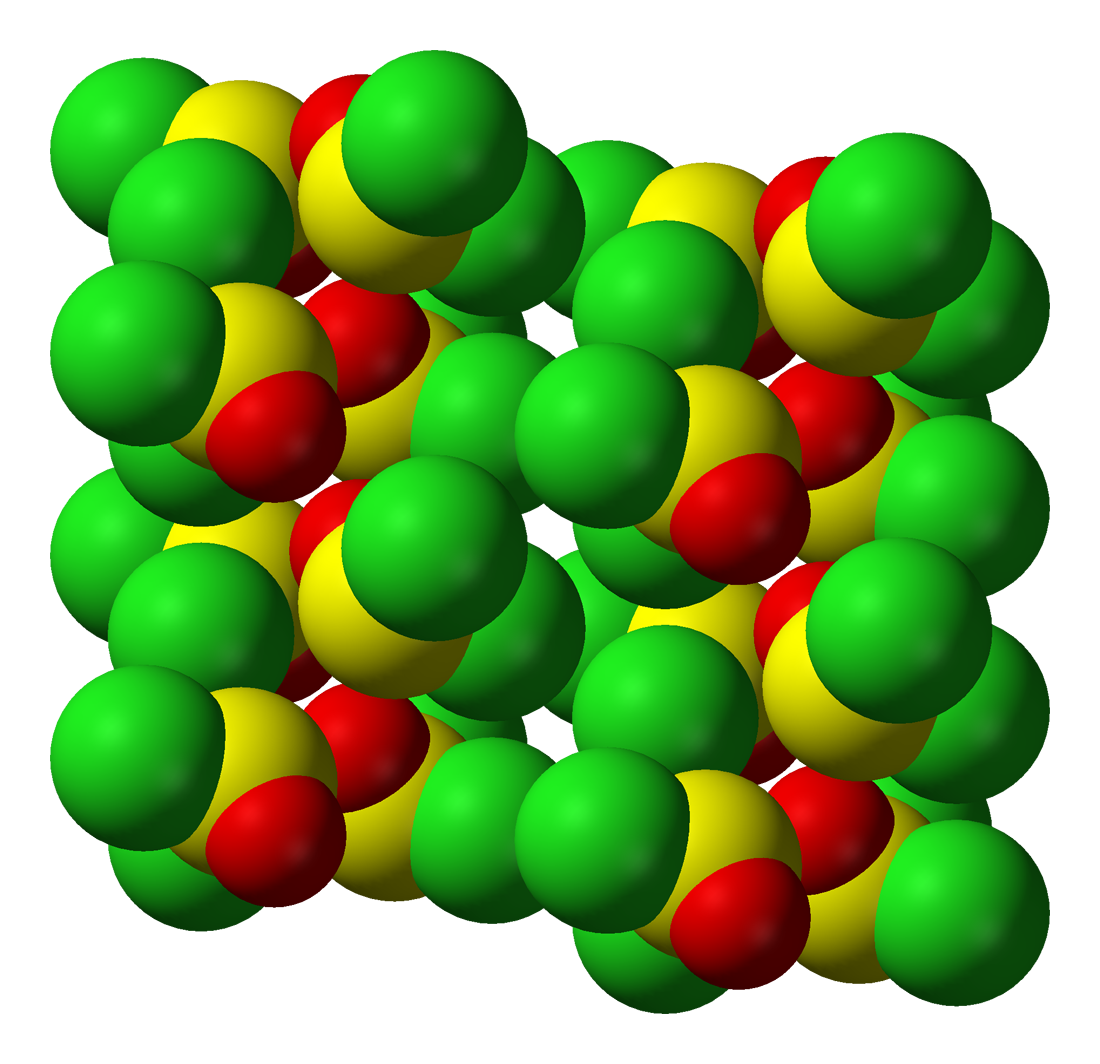
염화 티오닐(SOCl2)은 Cs 분자 대칭성을 가진 삼각뿔 분자 구조를 갖는다. 이러한 구조는 중심 황(IV) 원자에 있는 비공유 전자쌍의 영향으로 나타난다.
고체 상태에서 염화 티오닐은 공간군 P21/c를 갖는 단사정계 결정을 형성한다.[11]
3. 2. 물리적 성질
염화 티오닐(SOCl2)은 Cs 분자 대칭성을 가진 삼각뿔 분자 구조를 갖는다. 이러한 구조는 중심 황(IV) 원자에 있는 비공유 전자쌍의 영향으로 나타난다.고체 상태에서 염화 티오닐은 공간군 P21/c를 갖는 단사정계 결정을 형성한다.[11] 염화 티오닐은 벤젠, 클로로포름, 사염화 탄소에 녹는다.
3. 3. 화학적 성질
염화 티오닐은 보존 기간이 길지만, 오래된 샘플은 이황화 이염화물이 생성되어 황색을 띤다. 끓는점 바로 위에서 열분해되어 S2Cl2, SO2, Cl2로 천천히 분해된다.[9][12] 염화 티오닐은 주로 라디칼 메커니즘을 통해 진행되는 광해리에 취약하다.[13] 오래되어 변색된 샘플은 감압 증류로 정제하여 무색 액체로 만들 수 있다.[14]
염화 티오닐은 벤젠, 클로로포름, 사염화 탄소에 녹는다. 물에 대해서는 격렬하게 발열 반응을 일으켜 이산화 황과 염화 수소가 된다. 또한 무수 금속 할로겐화물을 만들 때 탈수제로 사용하거나, 카르복실산 및 알코올의 염소화에 자주 사용된다.
:
:
:
특히 다른 할로겐화제와 달리, 반응 후 생성물이 HCl이나 SO2 등 가스이고 염화 티오닐 자체가 끓는점이 낮다는 점에서 반응계 외부로 제거하기 쉽다. 그러므로 실험실에서 히드록시기의 염소화에 주로 사용된다.
또한, 염화 티오닐에 의한 알코올의 염소화는 다른 염소화제와는 달리 반응 메커니즘이 SN1 반응도 SN2 반응도 아닌 것으로 알려져 있으며, 왈덴 반전 없이 입체 보존으로 반응이 진행된다. 이때의 반응 메커니즘으로 사원환 전이 상태가 제안되어 있다.
이러한 분자 내 치환 반응의 메커니즘은 SNi 메커니즘이라고 불린다.
끓는점 이상의 140 ℃ 이상으로 가열하면 분해되기 시작하여, 500 ℃가 되면 완전히 분해된다. 이 때, 이산화 황, 이염화 이황, 염소를 생성한다.[46]
:
4. 반응
염화 티오닐은 다양한 반응에 관여하는 매우 유용한 시약이다. 주요 반응은 다음과 같다.
::SOCl2 + H2O → 2 HCl + SO2
- 할로겐 교환 반응:
- 삼플루오르화 안티몬과 같은 불소화제와 반응하여 플루오르화 티오닐을 생성한다.
::3 SOCl2 + 2 SbF3 → 3 SOF2 + 2 SbCl3
- 브롬화 수소와 반응하여 브롬화 티오닐을 생성한다.
::SOCl2 + 2 HBr → SOBr2 + 2 HCl
- 친전자성 첨가 반응: 삼염화 알루미늄(AlCl3) 존재 하에 알켄에 첨가되어 설핀산으로 가수분해될 수 있는 알루미늄 착물을 형성하는 등 다양한 친전자성 첨가 반응에 참여한다.
- 가열: 140°C 이상으로 가열하면 분해되기 시작하여, 500°C에서 완전히 분해된다. 이 때, 이산화 황, 이염화 이황, 염소를 생성한다.[46]
::4SOCl2 → 2SO2 + S2Cl2 + 3Cl2
- 기타: 아릴 설피닐 클로라이드와 다이아릴 설폭사이드는 염화 티오닐과 트리플루오로메탄설폰산[32] 또는 BiCl3, Bi(OTf)3, LiClO4 또는 NaClO4와 같은 촉매[33][34] 존재 하에 아렌으로부터 제조할 수 있다. 실험실에서는 염화 티오닐과 과량의 무수 알코올을 반응시켜 염산의 무수 알코올 용액을 만들 수 있다.
4. 1. 알코올과의 반응
염화 티오닐은 알코올과 반응하여 할로알케인 (알킬 클로라이드)을 형성한다. 알코올이 키랄(chiral)일 경우, 이 반응은 일반적으로 입체 화학을 유지하는 SNi 반응 메커니즘을 통해 진행된다.[15] 그러나 사용된 정확한 조건에 따라 입체 반전도 달성될 수 있다. 역사적으로 염화 티오닐과 피리딘의 사용은 다르젠 할로겐화 반응이라고 불렸지만, 이 이름은 현대 화학자들에게는 거의 사용되지 않는다.
과량의 알코올과의 반응은 아황산 에스터를 생성하는데, 이는 강력한 메틸화, 알킬화, 하이드록시알킬화 시약이 될 수 있다.[16] 예를 들어 염화 티오닐을 아미노산과 메탄올에 첨가하면 선택적으로 해당 메틸 에스터가 생성된다.[17]
다른 할로겐화제와 달리, 반응 후 생성물이 HCl이나 SO2 등 가스이고 염화 티오닐 자체가 저비점이라는 점에서 반응계 외부로 제거하기 쉽다. 그러므로 실험실에서 히드록시기의 염소화에 선호하여 사용된다.
또한 염화 티오닐에 의한 알코올의 염소화는 다른 염소화제와 달리 반응 메커니즘이 SN1 반응도 SN2 반응도 아닌 것으로 알려져 있으며, 왈덴 반전 없이 입체 보존으로 반응이 진행된다. 이때의 반응 메커니즘으로 사원환 전이 상태가 제안되어 있다.
이러한 분자 내 치환 반응의 메커니즘은 SNi 메커니즘이라고 불린다.
4. 2. 카복실산과의 반응
전통적으로 염화 티오닐은 카복실산을 아실 클로라이드로 전환시킨다.[18][19][20]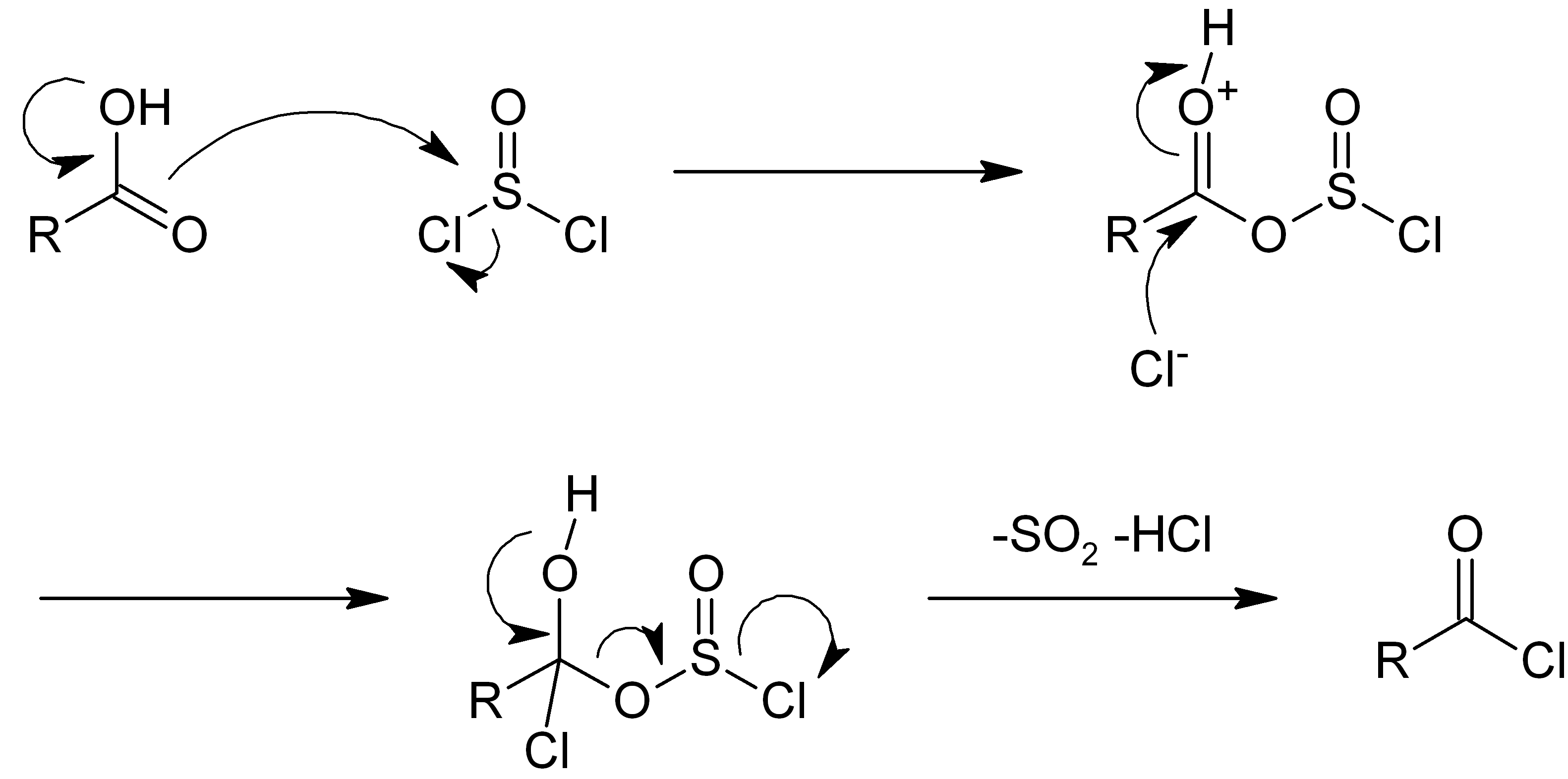
:
반응 메커니즘이 연구되었다.[21]
4. 3. 질소 화합물과의 반응
염화 티오닐은 1급 아민과 반응하여 설피닐아민 유도체(RNSO)를 생성하며, 그 예로 ''N''-설피닐아닐린이 있다. 염화 티오닐은 1급 폼아미드와 반응하여 이소시아나이드를 생성하고[22], 2급 폼아미드와 반응하여 클로로이민늄 이온을 생성한다. 디메틸폼아미드와 반응하면 빌스마이어 시약이 생성된다.[23]유사한 과정을 통해 1급 아미드는 염화 티오닐과 반응하여 이미도일 클로라이드를 생성하고, 2급 아미드는 또한 클로로이민늄 이온을 생성한다. 이들은 반응성이 높아 카르복실산을 아실 클로라이드로 전환하는 반응을 촉매하는 데 사용될 수 있으며,[24] 비스슐러-나피에르스키 반응에서 이소퀴놀린을 형성하는 수단으로도 활용된다.
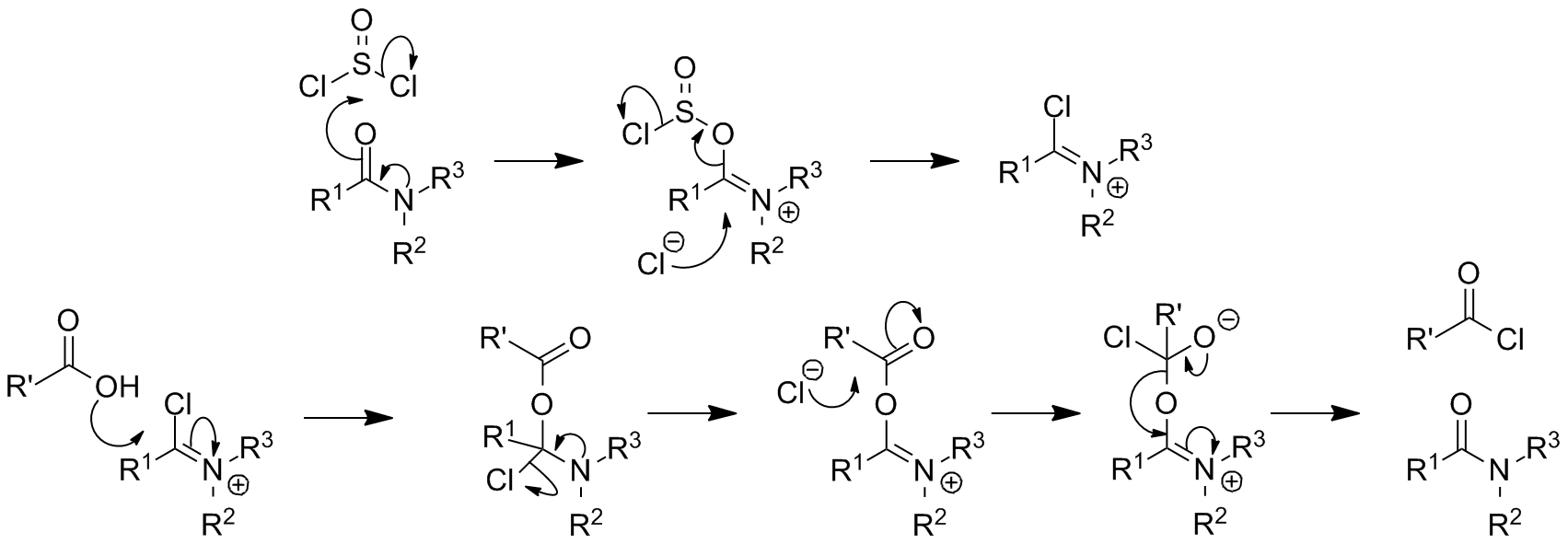
1급 아미드는 가열하면 니트릴을 형성하는 반응으로 이어진다 (폰 브라운 아미드 분해).[25]
염화 티오닐은 또한 옥심의 벡만 전위 반응을 촉진하는 데 사용되어 왔다.
4. 4. 황 화합물과의 반응
- 염화 티오닐은 설핀산을 설피닐 클로라이드로 변환시킨다.[26][27]
- 염화 티오닐은 술폰산과 반응하여 술포닐 클로라이드를 생성한다.[28][29] 술포닐 클로라이드는 해당 다이아조늄 염이 염화 티오닐과 직접 반응하여 얻어지기도 한다.[30]
- 염화 티오닐은 푸머러 재배열의 변형에 사용될 수 있다.
4. 5. 인 화합물과의 반응
염화 티오닐은 포스폰산과 포스폰산염을 인산염으로 변환한다. 이러한 유형의 반응 때문에 염화 티오닐은 G-시리즈 신경 작용제를 생산하는 "di-di" 방법에 사용될 수 있어 부속서 3 화합물로 등재되어 있다. 예를 들어 염화 티오닐은 디메틸 메틸포스포네이트를 메틸포스폰산 디클로라이드로 변환하며, 이는 사린과 소만의 생산에 사용될 수 있다.[4]4. 6. 금속과의 반응
염화 티오닐(Thionyl chloride영어)은 물과 반응하기 때문에, 염화 마그네슘(MgCl2•6H2O), 염화 알루미늄(AlCl3•6H2O), 염화 철(III)(FeCl3•6H2O)과 같은 다양한 금속 염화물 수화물을 탈수하는 데 사용할 수 있다.[9] 이러한 변환은 염화 티오닐을 사용하여 환류 처리를 포함하며, 다음과 같은 일반적인 방정식을 따른다:[31]: MCln•xH2O + x SOCl2 → MCln + x SO2 + 2x HCl
4. 7. 기타 반응
염화 티오닐은 물과 격렬하게 반응하여 이산화 황과 염산을 생성한다.[15]:
비슷하게, 알코올과 반응하여 할로알케인 (알킬 클로라이드)을 만든다. 알코올이 키랄(chiral)이면, 이 반응은 보통 입체 화학을 유지하는 SNi 반응 메커니즘으로 진행된다.[15] 그러나, 사용 조건에 따라 입체 반전도 가능하다. 과거에는 피리딘을 사용하는 반응을 다르젠 할로겐화 반응이라고 불렀지만, 현대 화학에서는 거의 사용되지 않는다.
과량의 알코올과 반응하면 아황산 에스터를 생성하는데, 이는 강력한 메틸화, 알킬화, 하이드록시알킬화 시약이 될 수 있다.[16]
:
예를 들어, 염화 티오닐을 아미노산의 메탄올 용액에 첨가하면 선택적으로 해당 메틸 에스터가 생성된다.[17]
염화 티오닐은 다양한 친전자성 첨가 반응에 참여할 수 있다. 삼염화 알루미늄(AlCl3) 존재 하에 알켄에 첨가되어 설핀산으로 가수분해될 수 있는 알루미늄 착물을 형성한다. 아릴 설피닐 클로라이드와 다이아릴 설폭사이드는 염화 티오닐과 트리플루오로메탄설폰산[32] 또는 , , 또는 와 같은 촉매[33][34] 존재 하에 아렌으로부터 만들 수 있다.
실험실에서 염화 티오닐과 과량의 무수 알코올 간의 반응을 통해 염산의 무수 알코올 용액을 만들 수 있다.
염화 티오닐은 할로겐 교환 반응을 통해 다른 티오닐 화합물을 생성한다.
- 삼플루오르화 안티몬과 같은 불소화제와 반응하여 플루오르화 티오닐을 생성한다.
::
- 브롬화 수소와 반응하여 브롬화 티오닐을 생성한다.
::
염화 티오닐은 카르복실산 및 알코올의 염소화에 자주 사용된다.
:
:
특히 다른 할로겐화제와 달리, 반응 후 생성물이 HCl이나 등 가스이고, 염화 티오닐 자체가 끓는점이 낮아 반응계 외부로 제거하기 쉽다. 따라서 실험실에서 히드록시기의 염소화에 선호된다.
또한, 염화 티오닐에 의한 알코올의 염소화는 다른 염소화제와 달리 반응 메커니즘이 SN1 반응도 SN2 반응도 아닌 것으로 알려져 있으며, 왈덴 반전 없이 입체 보존으로 반응이 진행된다. 이때의 반응 메커니즘으로 사원환 전이 상태가 제안되어 있다.
이러한 분자 내 치환 반응 메커니즘을 SNi 메커니즘이라고 한다.
140°C 이상으로 가열하면 분해되기 시작하여, 500°C가 되면 완전히 분해된다. 이 때, 이산화 황, 이염화 이황, 염소를 생성한다.[46]
:
5. 리튬-염화 티오닐 전지
염화 티오닐은 리튬 전지의 양극(전지: 음극)으로 사용되며, 리튬은 음극(양극)을 형성한다. 전해질은 일반적으로 테트라클로로알루민산리튬을 사용한다.[37] 방전 반응은 다음과 같다.
:
리튬-염화 티오닐 전지는 높은 에너지 밀도, 넓은 작동 온도 범위, 긴 보관 및 작동 수명 등 다른 형태의 리튬 전지에 비해 장점이 있다. 그러나 높은 가격, 재충전 불가능, 안전 문제 등으로 인해 사용이 제한적이다. 전지 내부는 독성이 강해 특별한 폐기 절차가 필요하며, 단락 시 폭발할 수 있다. 이 기술은 1997년 소저너 화성 탐사 로버에 사용되었다.
6. 안전성
염화 티오닐(SOCl2)은 반응성이 매우 높아 물이나 알코올과 접촉하면 염산을 격렬하게 방출할 수 있다. 또한 G-series 신경 작용제[38] 제조에 사용되고 황 기반 겨자 가스를 생산하는 마이어 및 마이어-클라크 방법에 사용되기 때문에 화학 무기 금지 조약에 따라 일정 3 물질로 지정된 규제 물질이다.[38]
7. 역사
1849년, 프랑스 화학자 장프랑수아 페르소와 블로흐, 그리고 독일 화학자 페터 크레머스(1827–?)는 독립적으로 오산화 인과 이산화 황을 반응시켜 염화 티오닐을 최초로 합성했다.[39][40] 그러나 그들의 생성물은 불순했다. 페르소와 크레머스 모두 염화 티오닐에 인이 포함되어 있다고 주장했고,[41] 크레머스는 끓는점을 100°C(실제로는 74.6°C)로 기록했다. 1857년, 독일계 이탈리아 화학자 휴고 쉬프는 조잡한 염화 티오닐을 반복적인 분별 증류에 적용하여 82°C에서 끓는 액체를 얻었고, 이를 '티오닐클로리드'라고 불렀다.[42] 1859년, 독일 화학자 게오르그 루드비히 카리우스는 염화 티오닐을 사용하여 카르복실산으로부터 유기산 무수물과 아실 클로라이드를 만들고, 알코올로부터 알킬 클로라이드를 만들 수 있다는 것을 알아냈다.[43]
참조
[1]
서적
Handbook of Inorganic Chemicals
https://archive.org/[...]
McGraw-Hill
2003
[2]
간행물
2014-05-11
[3]
서적
CRC Handbook of Chemistry and Physics
CRC Press
1996
[4]
문서
[5]
간행물
Sulfur Halides
[6]
논문
Some Applications of Thionyl Chloride in Synthetic Organic Chemistry
1981
[7]
논문
Syntheses of carbonyl halides of late transition elements in thionyl chloride as solvent. Carbonyl complexes of palladium(II)
1981-04
[8]
논문
Titration of Aprotic Acids in Thionyl Chloride
1953-04-20
[9]
간행물
[10]
서적
Handbook of Preparative Inorganic Chemistry
1963
[11]
논문
Structures of thionyl halides: SOCl2 and SOBr2
http://journals.iucr[...]
1988-05-15
[12]
서적
Handbook of Preparative Inorganic Chemistry
Academic Press
1963
[13]
논문
Spectroscopic and kinetic studies of the SO radical and the photolysis of thionyl chloride
[14]
논문
Purification of thionyl chloride
1967
[15]
간행물
[16]
논문
Organic Sulfites
[17]
논문
Herstellung von α-Aminosäureestern durch Alkoholyse der Methylester
[18]
간행물
[19]
간행물
Oleoyl chloride
[20]
간행물
1-Methyl-3-ethyloxindole
[21]
간행물
[22]
간행물
1-''d''-Aldehydes from organometallic reagents: 2-methylbutanal-1-''d''
[23]
논문
''N'',''N''-Dimethylchlorosulfitemethaniminium chloride (SOCl2-DMF) a versatile dehydrating reagent
[24]
서적
Organic Chemistry
https://archive.org/[...]
Oxford University Press
[25]
간행물
2-Ethylhexanonitrile
[26]
간행물
(''S'')-(+)-2-(''p''-toluenesulfinyl)-2-cyclopentenone: Precursor for enantioselective synthesis of 3-substituted cyclopentanones
[27]
간행물
''p''-Toluenesulfinyl chloride
[28]
간행물
2-Trimethylsilylethanesulfonyl chloride (SES-Cl)
[29]
간행물
4-Dodecylbenzenesulfonyl azides
[30]
논문
Aqueous Process Chemistry: The Preparation of Aryl Sulfonyl Chlorides
[31]
서적
Inorganic Syntheses
[32]
간행물
[33]
논문
Catalytic Lewis Acid Activation of Thionyl Chloride: Application to the Synthesis of Aryl Sulfinyl Chlorides Catalyzed by Bismuth(III) Salts
2003
[34]
논문
Lithium/Sodium Perchlorate Catalyzed Synthesis of Symmetrical Diaryl Sulfoxides
[35]
논문
Thionyl iodide: Part I. Formation of thionyl iodide
1940-03
[36]
논문
Thionyl iodide: Part II. Rate of decomposition and spectroscopic
1940-03
[37]
논문
The lithium—thionyl chloride battery — a review
1979-01
[38]
서적
Veterans at Risk: The Health Effects of Mustard Gas and Lewisite
http://books.nap.edu[...]
The National Academies Press
[39]
논문
Des composés binaires formés par les métalloïdes, et, en particulier, de l'action du chloride phosphorique sur les acides sulfureux, sulfurique, phosphorique, chromique, etc.
https://babel.hathit[...]
1849
[40]
논문
Ueber schwefligsaures Phosphorchlorid
https://babel.hathit[...]
1849
[41]
논문
Ueber die Chloride des Schwefels und deren Derivate
https://babel.hathit[...]
1859
[42]
논문
Ueber die Einwirkung des Phosphorsuperchlorids auf einige anorganische Säuren
https://babel.hathit[...]
1857
[43]
논문
Ueber die Chloride des Schwefels und deren Derivate
https://babel.hathit[...]
1859
[44]
웹사이트
毒物及び劇物指定令 昭和四十年一月四日 政令第二号 第二条 十七の二
http://wwwhourei.mhl[...]
[45]
웹사이트
化学兵器の禁止及び特定物質の規制等に関する法律施行令(平成七年五月一日政令第百九十二号)第一条 別表
https://www.meti.go.[...]
[46]
논문
塩化チオニル
https://doi.org/10.5[...]
有機合成化学協会
2020-08-21
[47]
서적
Handbook of Inorganic Chemicals
https://archive.org/[...]
McGraw-Hill
2003
[48]
웹사이트
2014-05-11
[49]
서적
CRC Handbook of Chemistry and Physics
CRC Press
1996
[50]
간행물
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


